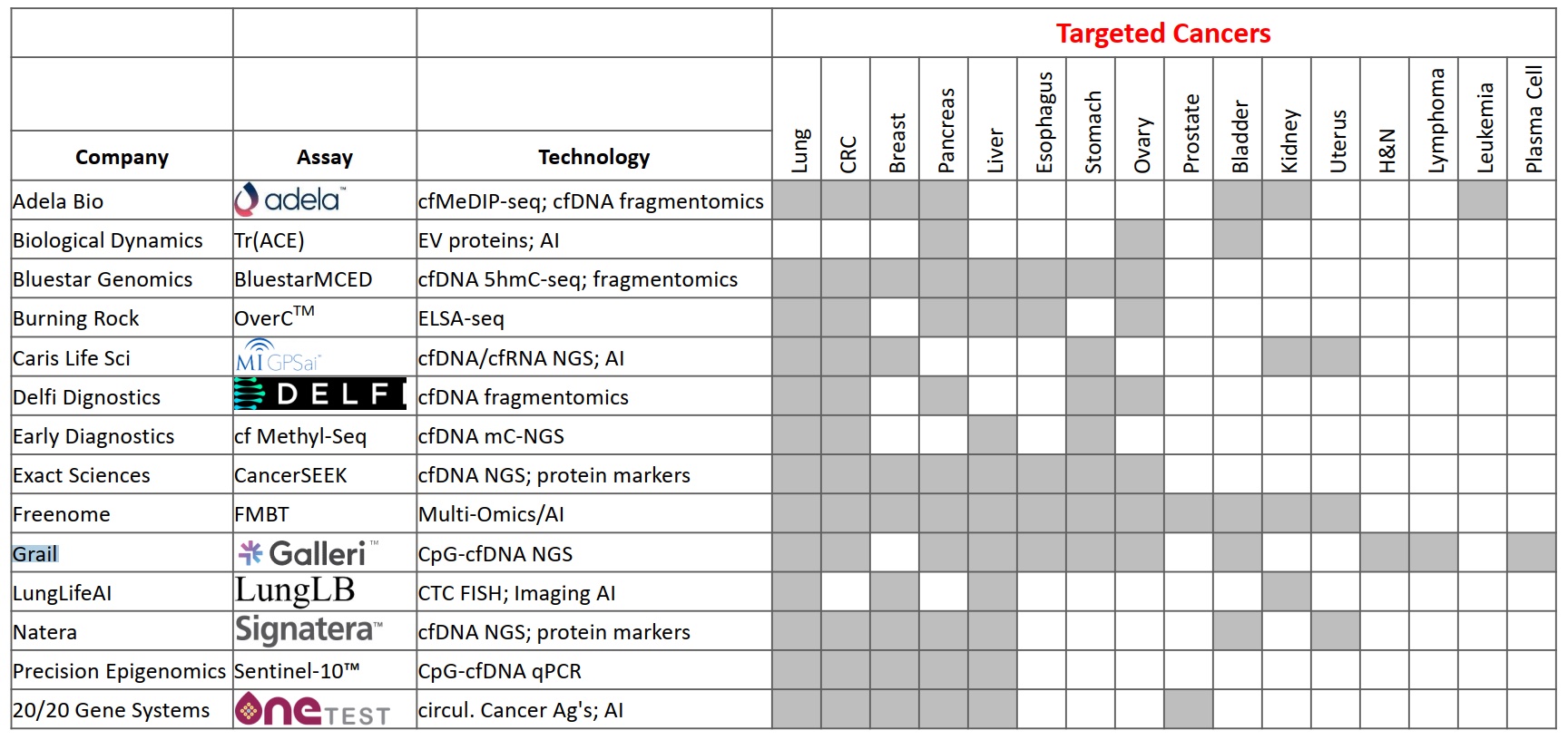
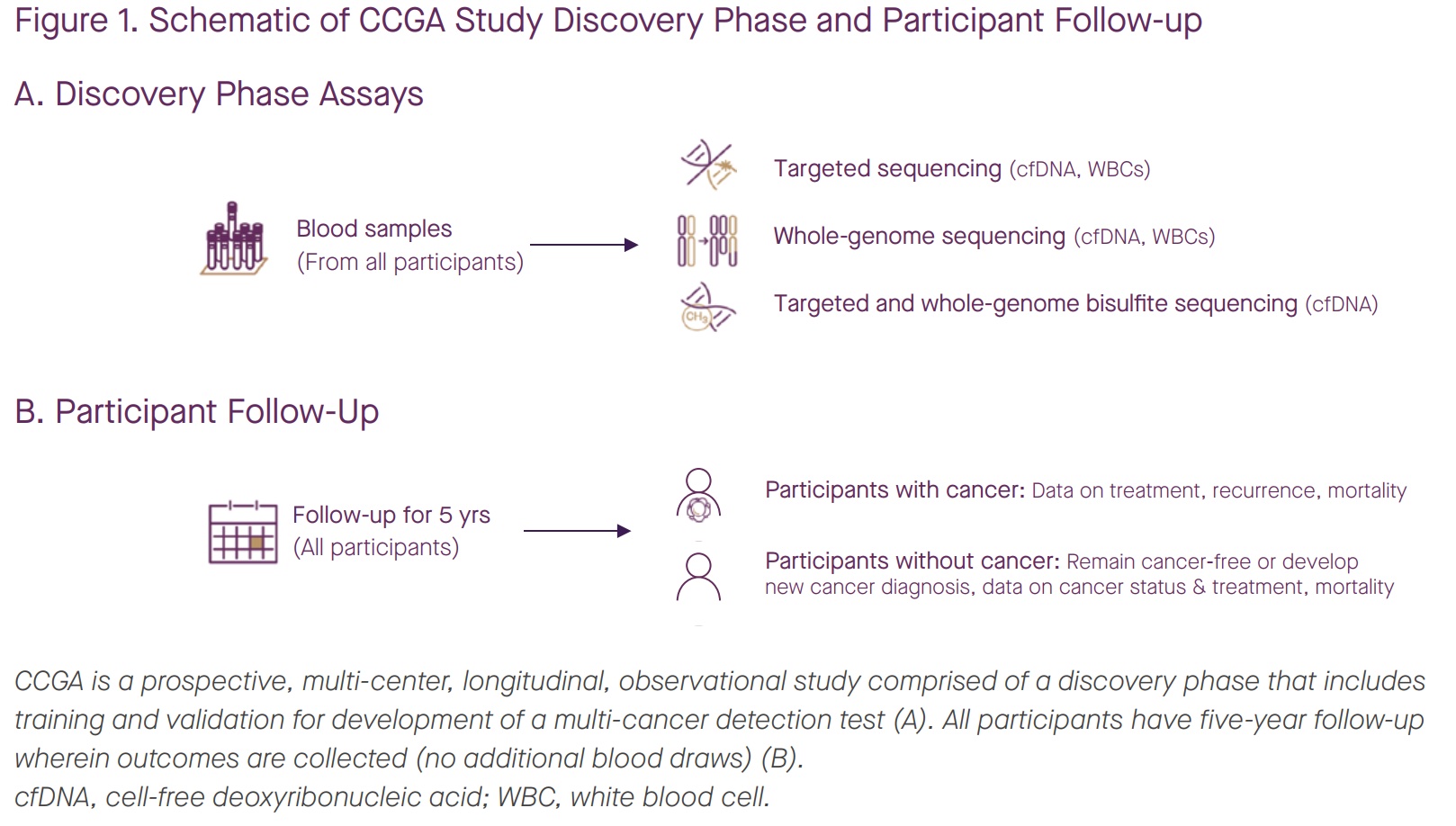
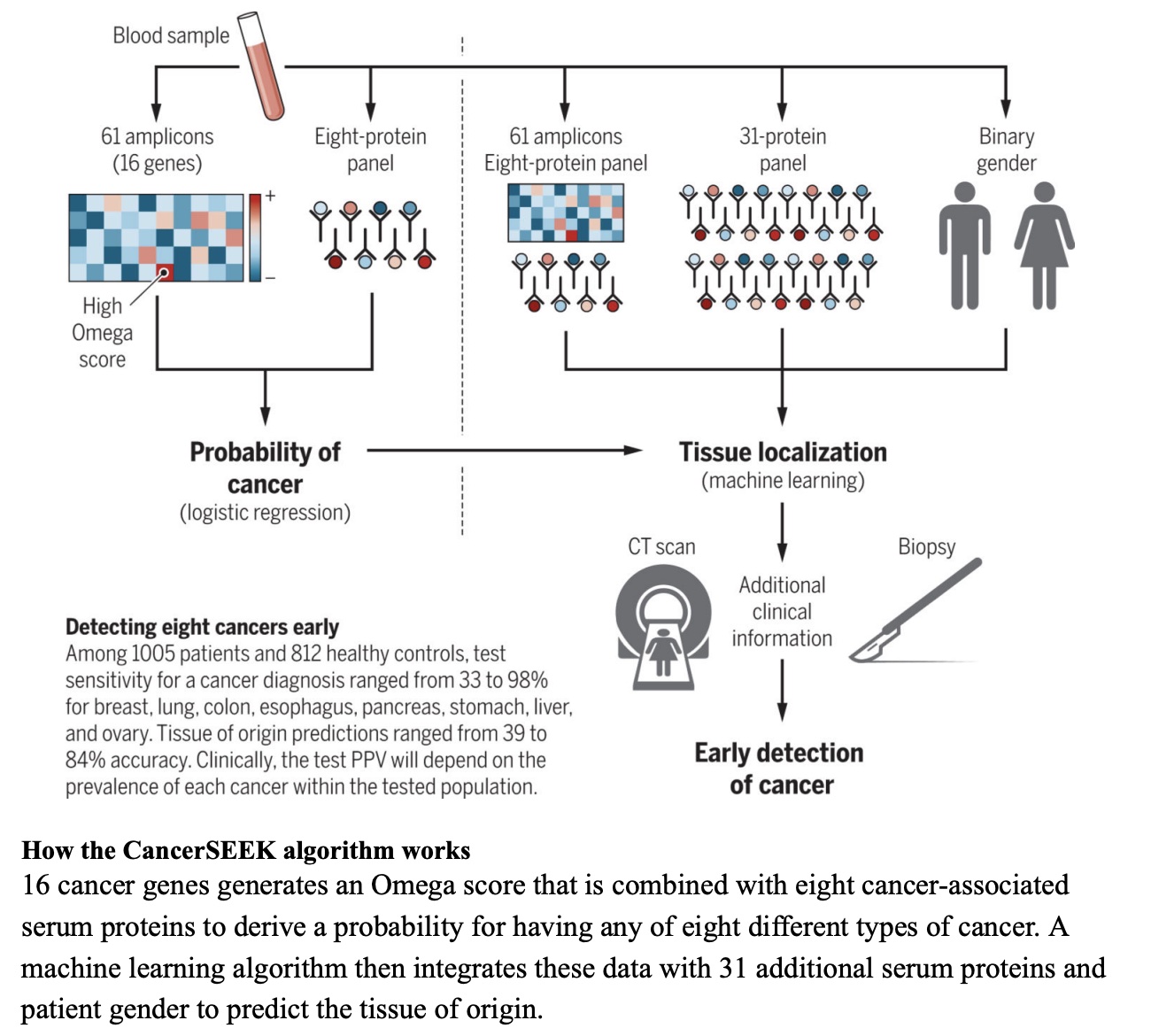
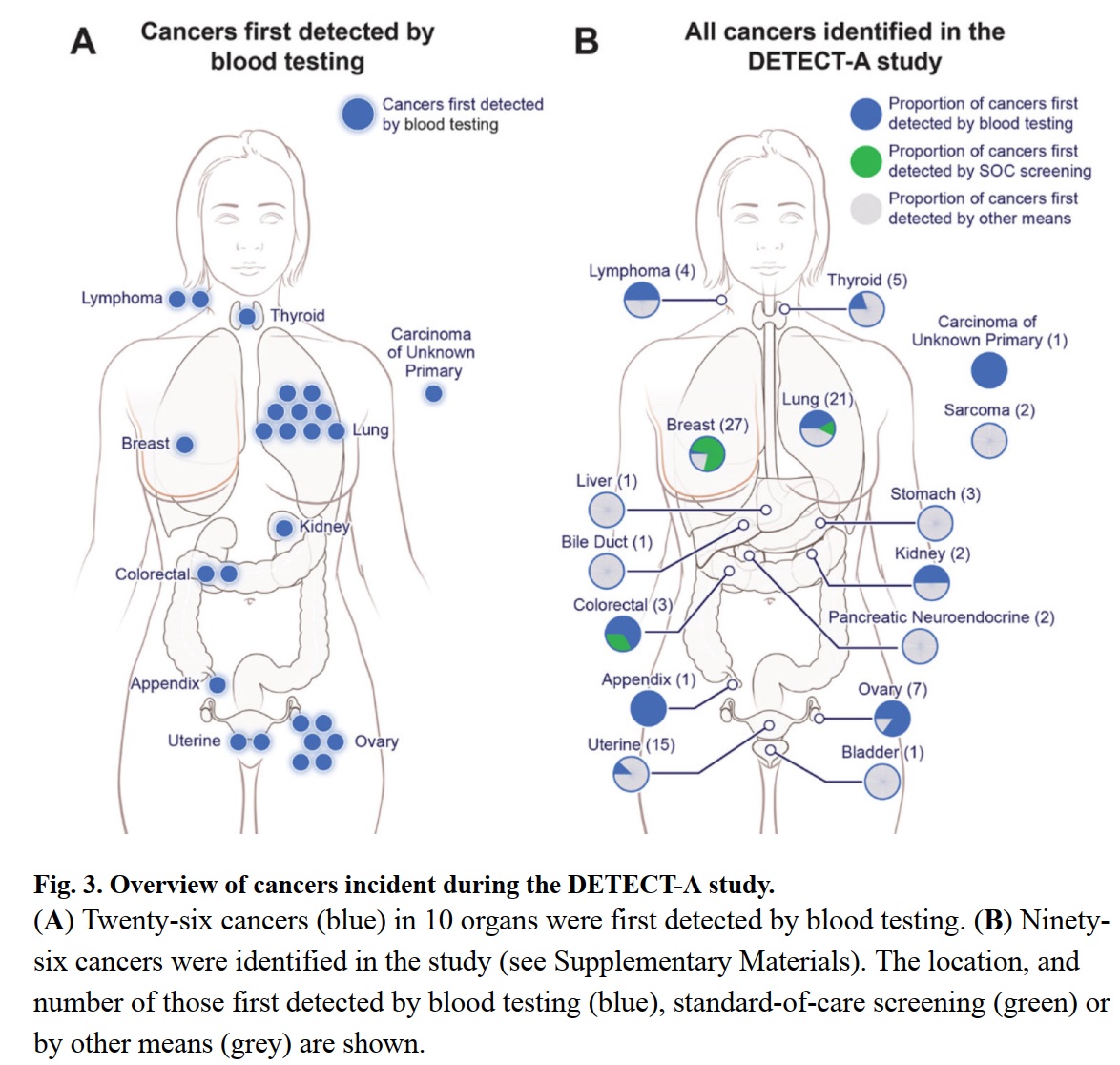
本文为熊言熊语邮件通讯会员计划内容的完整试读版,更多内容欢迎点击通讯主页订阅并查看。 本期内容: 上周,国内肿瘤NGS检测公司燃石医学发布了一篇新闻稿,其中写道: 自主研发的多癌种早检产品OverC Multi-Cancer Detection Blood Test(以下简称OverC)获得美国FDA授予的“突破性医疗器械”(Breakthrough Device Designation)认定,成为全球第三个获得此项认定的多癌种早检产品。 OverC 可以通过抽取一管外周血(8~10毫升),为50-75岁的受检人筛查肺癌、肝癌等多个癌种,并进行组织溯源,提示癌症相关甲基化信号的来源器官,临床医生可根据筛查结果进行针对性检查并进一步诊断。 而基于OverC和ELSA-seq技术,燃石目前也在国内启动了PREDICT、PRESCIENT和PREVENT三个大型临床研究(如下图介绍)。 关于这则新闻,你可以通过其公众号查看或者在官网阅读英文介绍。我看完之后,它背后没有写出来的几个内容反而勾起了自己的好奇心。 比如,文章中提到OverC是全球第三个获得此项认定的多癌种早检产品,那么第一个和第二个又是谁,这两家公司和产品如今怎么样了呢? 再比如,FDA Breakthrough Device Designation 是什么,它的申请需要符合什么条件,有了FDA BDD认证究竟又意味着什么? 带着这两个维度的好奇,通过本期内容,我希望和你就上面的内容展开聊聊,同时也希望像 从2002年的Nature论文到2022年的亿元营收 这篇文章一样向你尝试距离剖析自己看到一篇文章之后的思考路径。 「多癌种早筛」在不同的公司和产品语境下有不同叫法,比如 Multi-Cancer Detection assays (MCDs) 或者 Multi-Cancer Early Detection assays (MCEDs)。在上面提到的燃石OverC中,又被称为 Multi-Cancer Detection Blood Test (MCDBT)。所以如果今后你看到诸如 MCD、MCED 或者 MCDBT 这样的缩写,不用怀疑,它们都指的是多癌种早筛这一件事。 目前国内外涉及到多癌种早筛业务的主要公司,可以参考下面这张图。 而它们的主要产品和技术以及覆盖癌种,可以参考下面这张图。 👆这两张图涉及到的公司产品和技术,有不少值得我们单独继续学习了解,今后会陆续涉及到。 今天,我们暂时聚焦于FDA授予突破性医疗器械(Breakthrough Device Designation,BDD)认定的前两家公司。嗯,某种意义上说它们倒也都在这两幅图里。 如果你对多癌种早筛这个技术或者市场略有了解,不难猜到其中应该有一家是目前专注在MCED领域的领头羊 Grail。如果你感兴趣Grail 2022年的业务表现,可以参考我前几天写的和头部肿瘤早筛公司 GRAIL CEO 学写年终工作总结。 事实也确实如此,时间回到四年前,2019年5月13号 GRAIL在其官网宣布自己的 Multi-Cancer Early Detection Test 获得FDA BDD 认证(for its blood test being developed to detect multiple cancer types in people aged 50 years and above)。 彼时,GRAIL 如今最受关注的 PATHFINDER和PATHFINDER 2研究还没什么影子,其最重要的研究结果是 Circulating Cell-free Genome Atlas (CCGA)。 在这项研究中,GRAIL希望从不同的NGS检测方法出发,去探索癌症患者和正常人血液中的基因组癌症信号特征。这其中就包括如今被广泛采用的甲基化策略、所谓cfDNA的片段组学以及染色体突变缺失特征等等。 在2019年的ASCO会议上,GRAIL 一口气发了好几篇poster来介绍CCGA项目的研究成果。 通过CCGA的子研究,其最终选择甲基化作为首选方法来同时检测多种类型癌症并进行组织溯源。 这套基于甲基化数据进行早筛检测和溯源的策略,国内目前开展最好的也是燃石。不过,从 FDA BDD 批准时间和几个大型临床试验开展进度看,和 Grail 线性相比大致要慢个2年左右时间。 如果你对于这些技术之间的更多细节感兴趣,Grail 最近在 Cancer Cell 发表了题为 Evaluation of cell-free DNA approaches for multi-cancer early detection的文章,(从他们的视角)详细比较了不同技术之间的优劣,最后的结论当然甲基化技术是坠好的。 Grail 的确是目前发展最快的专注于肿瘤早筛的公司。不过它确不是第一家获得该类FDA BDD认证的企业。 时间再往前回溯到2011年,来自约翰霍普金斯大学的液体活检早筛研究团队开发了一项名为SafeSeqS的NGS测序技术。 两年后,SafeSeqS被纳入他们的一项液体活检试点研究中,该测试使用常规巴氏检查中获得的宫颈液来检测子宫内膜癌和卵巢癌。在这项研究中,使用 Papgene 方法测出了所有24例子宫内膜癌和22例卵巢癌中的9例,这一研究结果于2013年发表在 Science Translational Medicine。 2015年,团队中的 Papadopoulos, Kinzler 和 Vogelstein 三个人在约翰·霍普金斯风险投资公司(JHTV)的帮助下,成立了一家名字就叫做 Papgene 的初创公司并计划将这项技术商业化。 与此同时,三位创始人再接再厉,开发了另一个多种类型的癌症液体活检技术 CancerSEEK。2018年初,发表在 Science 杂志上的一项研究对 CancerSEEK 的八种癌症类型检测效果进行了分析,发现它对卵巢、肝癌、胃癌、胰腺和食管癌癌的特异性超过99%,敏感性则从69%到98%不等。 随后,2018年8月8号,PapGene 宣布 FDA 基于其产品同时检测卵巢癌和胰腺癌的能力,正式授予 PapGene Blood-Based Cancer Test BDD 认证(uses a combination of circulating tumor DNA and protein biomarkers to detect cancers in average-risk, asymptomatic individuals over the age of 65)。 嗯,PapGene 就是第一个获得该项认证的泛癌种早筛产品了。 不过,一年后,随着 CancerSEEK 的影响力扩大和产品日渐成熟,PapGene 这家初创公司最终改名为 Thrive Earlier Detection Corp 并完成首轮1.1亿美元融资,同时获得了CancerSEEK 和 SafeSeqS 的商业授权。曾在 Foundation Medicine 担任了5年 COO 的Steven J. Kafka 成为了 Thrive 首任CEO兼执行主席。 2020年4月,Thrive和约翰霍普金斯大学的研究人员宣布有9911名没有癌症证据或病史的女性接受了基于 CancerSEEK 的多癌血液检测,并检测到26种未诊断的癌症,而这项发表在Science名为 DETECT-A 的研究也是首次将液体活检血液测试用于这一目的。 三个月后,2020年8月 Thrive 宣布再融资2.57亿美元,再三个月后,Exact Sciences 宣布以超过 21.5 亿美元的价格收购 Thrive,并在2021年初正式完成了这一收购。 从 Papgene 到 Thrive 再到 Exact Sciences,这也就是为什么在文章开头的那幅图里,CancerSeek 目前是 Exact Sciences 的技术,以及我提到的某种意义上说 FDA BDD 认证的三家公司和泛癌种早筛产品都在那两幅图里。 这里可以多说几句的是,同样在 2020 年, Exact Sciences 还以4.1亿美元收购了另外一家从高校走出的癌症检测公司 Base Genomics,其核心DNA甲基化检测技术 TAPS 由牛津大学 ludwig 癌症研究中心的华人科学家 Chunxiao Song 团队开发。Base Genomics + Thrive 也就构成了Exact Sciences如今的MCED。 如果再多说一句,我博士实验室的一位大牛师姐此时正在Song lab做博士后,继续优化开发基于TAPS的扩展方法。是的,世界就是这么小。 GRAIL 和 Thrive 两家公司,如今前者被illumina收购保持独立运营,后者被 Exact Sciences 收购。其实肿瘤NGS领域的另一家头部公司 Foundation Medicine 也早在2018被Roche完全收购并成为其独立子公司。 在肿瘤NGS检测这个领域,国外最近两年的不少公司的结局就是:小公司被大公司收购,大公司被药企巨头收购,下游厂商被上游供应商收购。 国内这些同类型公司未来两三年是否会出现比较大的格局变动,也值得持续关注。 另外,上文提到的 Steven J. Kafka 也是个神奇的公司领导人。 他在Foundation Medicine 担任五年COO之后,FMI 被 Roche 收购,随后在ArcherDX担任了2年执行主席之后这家公司被Invitae收购,紧接着加入的Thrive在他当了两年多执行主席之后又被 Exact Sciences 收购。嗯,易被收购体质。 以上,我们大致了解了 FDA BDD 认证的前两家泛癌种早筛公司,另一个还没有解决的小好奇就是 FDA Breakthrough Device Designation 究竟是什么? 作为 Expedited Access Pathway (EAP) 项目的一部分,FDA于2016年建立了 Breakthrough Devices Program 突破性设备计划。 如果想要申请 FDA BDD,需要满足一个必要条件和另一个四选一的补充条件。 必须要满足的一个条件是:该设备可以为威胁患者生命或不可逆转影响患者健康的疾病提供更有效的治疗或诊断。 必须要满足的补充条件(至少四选一)包括: 如果你认为自己的产品符合上述1+1条件,就可以在递交 Marketing Submission 之前的任意时间递交 Breakthrough Designation 申请。所谓的 Marketing Submission 包括为了在美国上市递交的 premarket approval (PMA), premarket notification (510(k)) 和 De Novo classification request。 如果你的产品通过了FDA BDD的认证,目前看来其最主要的优势是在后续申请 510k 和 De Novo submissions 时会比非BDD认证设备的优先级更高,且时间也会略短一些。此外,如果一个医疗设备通过了该认证,也可能在美国医疗保险报销中获得一定优势。然后,也就没有其它更直接的优势了。 目前获得了FDA BDD认证的设备有多少呢? 根据FDA官方数据,截至2022年9月30日,FDA 的 CDRH 和 CBER 已经批准了 728 个突破性设备认证。 不过需要特别注意的是,在上市授权之前 FDA 通常不会公开披露是否有厂商提交了设备突破性认定请求或 FDA 是否批准/拒绝了该请求,除非厂商决定主动向公众提供这些信息。 此外,FDA BDD 认证似乎和最后能否获得市场授权之间,也并没有体现出特别直接的关系。 过去在这 728 个突破性认定设备中,目前也仅有56个真正获得了market authorization。在其中包括FMI的 Foundation CDx、Foundation liquid CDx;Guardant 的 Guardant360 CDx。 所以获得 FDA BDD 认证确实是有意义的一步,不过更多的是有意义的起步。 如果你对本期话题有更多想分享和讨论的内容,不妨直接给我回复邮件。 如果你对这篇文章感兴趣,欢迎通过邮箱或者微信订阅我的 「熊言熊语」会员通讯,我将第一时间与你分享肿瘤生物医药领域最新行业研究进展和我的所思所学所想,点此链接即可进行免费订阅。
写在前面

多癌种早筛 FDA BDD 认证的前辈

当仁不让但并非首家的 Grail
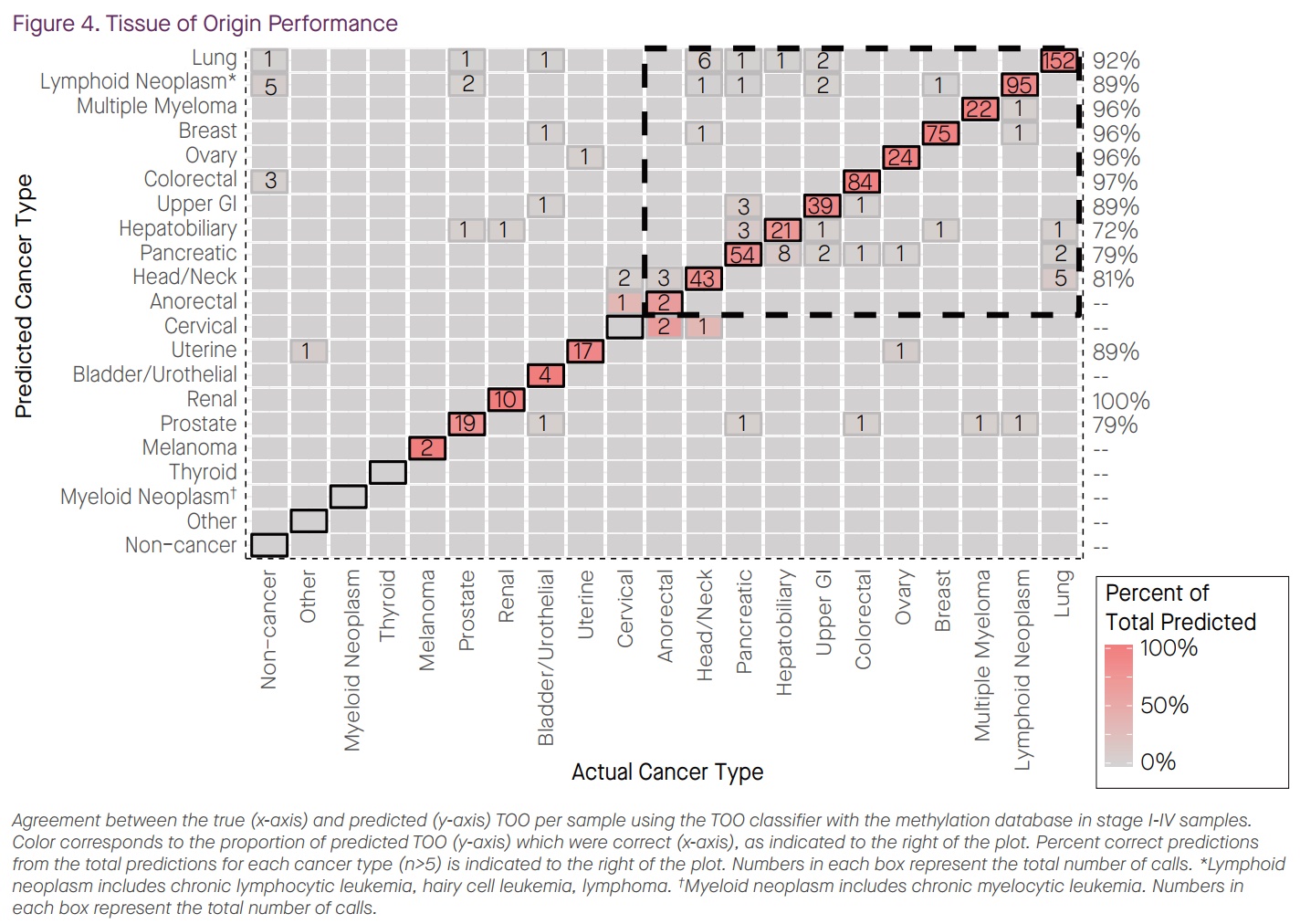
首家认证但已不存在的PapGene
和早筛产品技术无关的一点评论
关于 FDA Breakthrough Device Designation


· 分享链接 https://kaopubear.top/blog/2022-01-08-fda-bdd-multi-cancer-early-detection/