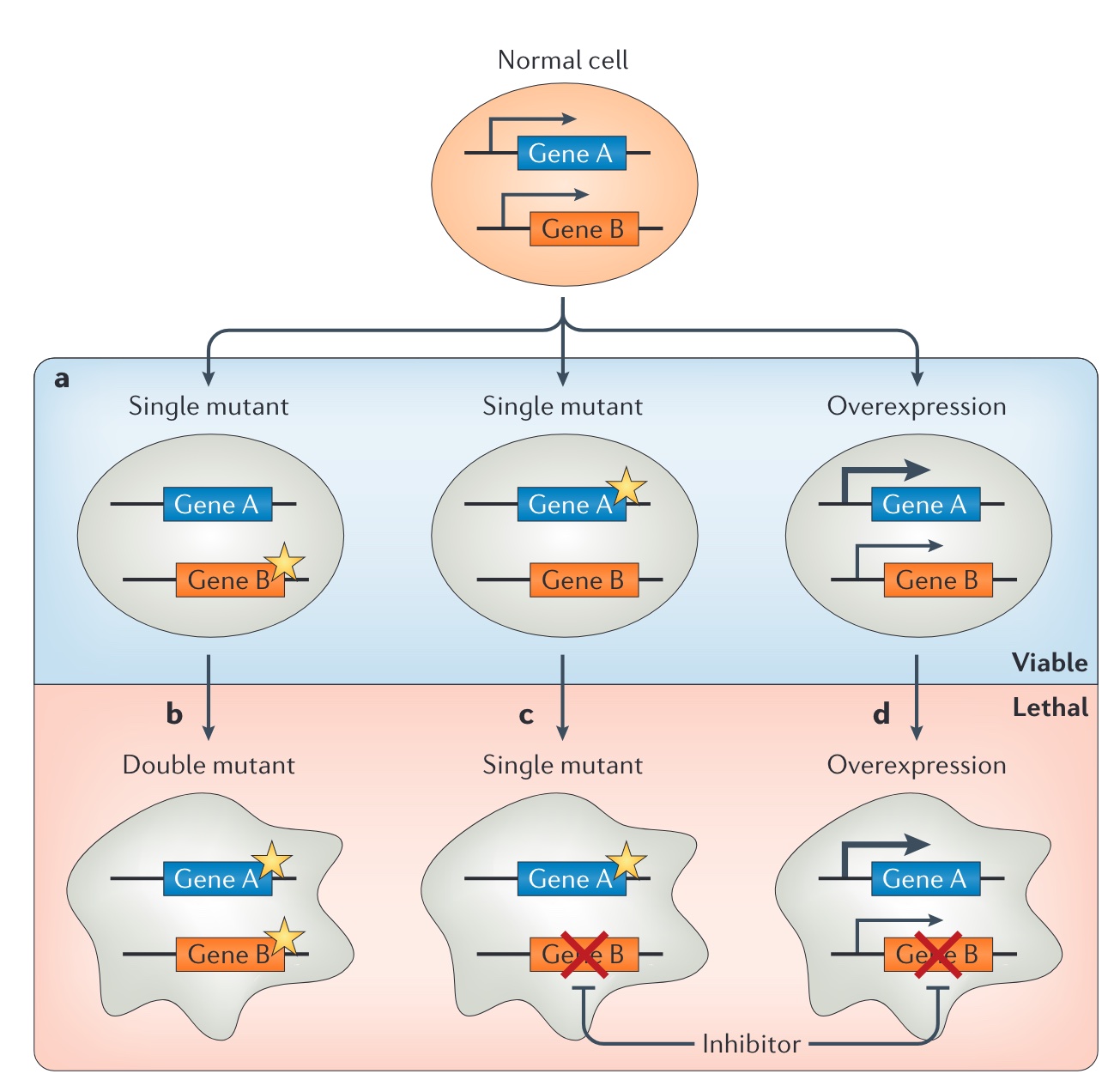
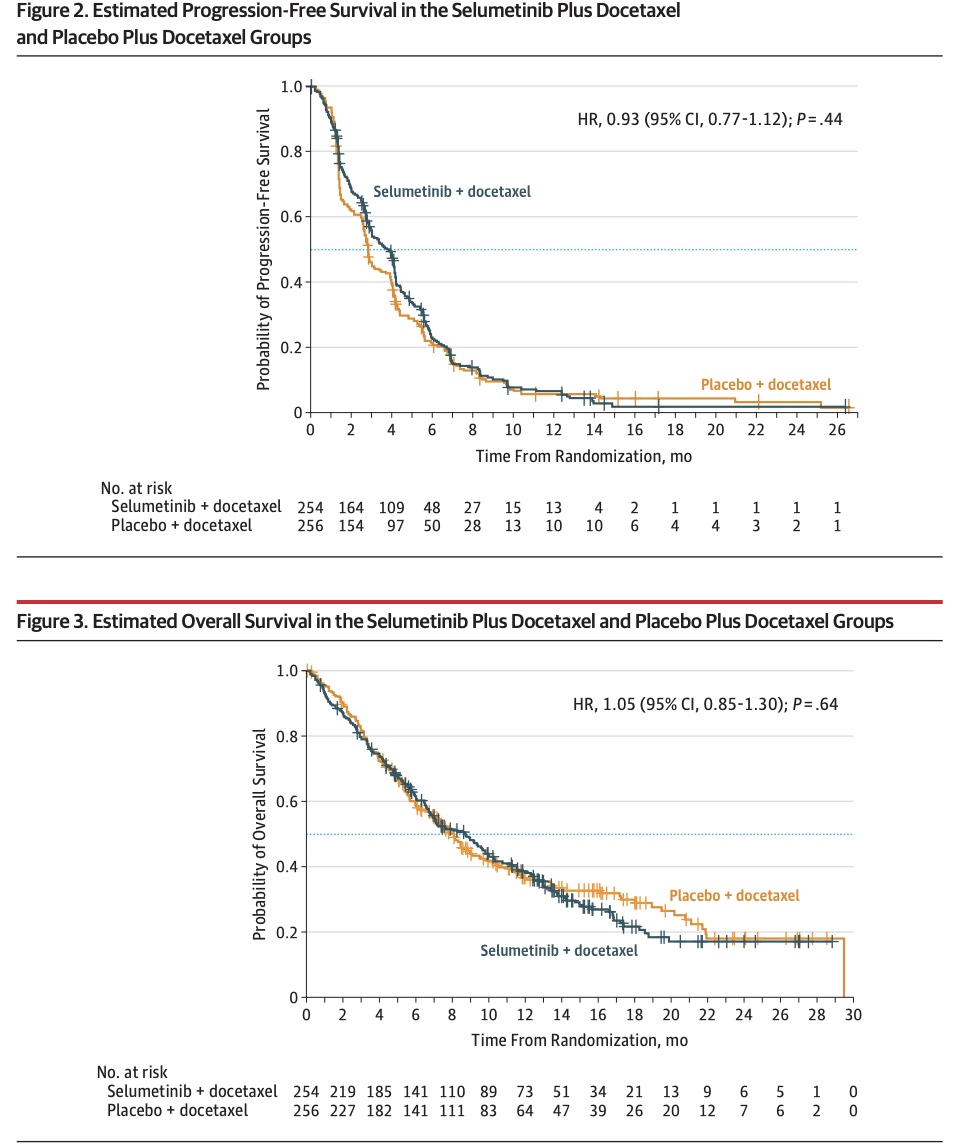
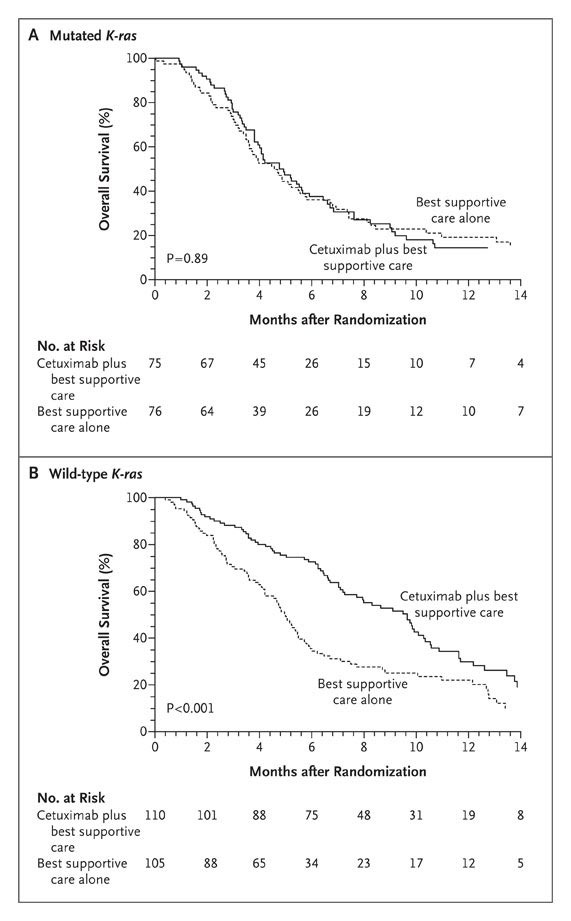
本文为熊言熊语邮件通讯会员计划内容的试读版,完整内容请点击通讯主页订阅并查看。 你好,我是思考问题的熊,本内容是参加会员计划读者的专属内容,感谢你通过会员计划支持我持续创作。展信佳~ 在2022年的最后一个工作日晚,提前祝你新年快乐。2023,我们继续一起前行。 本期内容: 在癌症治疗领域,一个又一个振奋人心的新药被开发出来,尽管这是巨大的进步,但它也带来一个新的难题:如何更好地结合许多新的药物以获得持久疗效。 2006年至2020年间,美国食品和药物管理局(FDA)共批准了72种不同的靶向药物,用于18种癌症的36种基因组适应症。这些药物的批准让符合基因组靶向治疗的患者数量逐渐增加,一项基于美国患者的研究显示从2006年的5%增加到2020年的13.6%。 尽管很多靶向治疗药物最初可能非常有效,但单药治疗的耐药仍然是一个重大挑战。耐药研究是肿瘤NGS领域一个非常重要的研究主题,这其中包括各类靶向治疗耐药和免疫治疗耐药。 本期内容我们将围绕靶向治疗的耐药机制这一话题进行了解,主要包括如下四部分内容 下期预告: 面对耐药,联合用药有时有助于克服耐药性,但药物组合的数量远远超过了可以进行临床试验的数量,此外还需要综合考虑患者承受的经济负担以及毒副作用等等。 因此,我们需要基于对耐药性相关潜在分子机制的深入了解,来确定潜在有效的药物组合抗耐药性。下期内容我们将会从本期的耐药机制出发,一起了解联合治疗策略和相关最新的研究进展。 以下为本期内容正文,7000字。 如我曾经在跨越60年的癌症靶向治疗里程碑这篇文章里提到的,过去二十年里,对癌症基础的研究使得我们拥有了大量的新型癌症靶向药物。 自从伊马替尼成功开发,用于治疗BCR-ABL驱动的慢性骨髓系白血病以来,「一个基因异常对应一种药物」就被认为是一种新的药物开发范式。 这一概念加速了一系列癌症靶向治疗的发现。不过,伊马替尼的成功在一定程度上误导了药物研发,因为这些患者在使用伊马替尼单药治疗时可以出现长时间的响应,但是多数其它靶向药物对单药治疗的反应却不持久。 2006年至2020年间,美国食品和药物管理局(FDA)共批准了72种不同的靶向药物,用于18种癌症的36种基因组适应症。这些药物的批准让符合基因组靶向治疗的患者数量逐渐增加,一项基于美国患者的研究显示从2006年的5%增加到2020年的13.6%。 在了解肿瘤相关的基因时,早期我们通常会把基因分为oncogene和tumor suppressor gene(TSG)。在提到多数靶向治疗时,我们多数关注的其实是oncogene发生gain-of-function的这种获得功能的显性突变,这类基因通常功能与细胞的增殖、生长与分化相关,其突变可以造成基因过度活跃,因而在癌症中抑制这些基因就可以限制癌症。 而TSG常见的突变是loss-of-function,这些突变造成的蛋白功能丧失在早期的研究中认为没有办法用来指导治疗决策和直接用药,但是合成致死(synthetic lethality)这一机制的提出改变了TSG LOF 无用的观点。 所谓合成致死,就是A和B两个基因任何一个突变都可以被容忍,但是如果AB两个基因同时突变就会导致细胞死亡。原则上,当两个突变对一个基础的生物学通路产生相加的负影响,或者当两个突变使两个不同但功能重叠的通路失活时,就可能导致合成致死。 在癌症治疗中,如果一个不可药用的TSG的LOF可以诱发对第二个基因的依赖,那么这个基因本身就是一个很好的药物靶点,能使TSG的LOF可以间接药用。针对一种对癌症相关突变具有合成致死的基因,应该只杀死癌细胞,而不会杀死正常细胞。因此,合成致死为开发癌症特异性药物就提供了一个新的概念性框架。 关于合成致死在肿瘤治疗领域目前最成功的应用就是BRCA突变的癌症对PARP抑制剂具有选择敏感性。BRCA突变会使肿瘤细胞同源重组介导的DNA修复存在缺陷(双链修复),因此它们高度依赖PARP介导的碱基切除修复(单链修复),如果针对BRCA突变的癌症使用PARP抑制剂,既可以组织DNA修复。如果负责双链断裂修复的BRCA突变失活,再把单链断裂修复的PARP抑制,癌细胞的DNA修复系统就会被破坏进而死亡。到目前为止,PARP抑制剂已被批准用于与BRCA1/2基因突变有关的卵巢癌、乳腺癌、前列腺癌和胰腺癌的临床使用。 不管是以上哪种机制或者是那种靶向药物,尽管它们最初可能非常有效,但单药治疗的耐药性仍然是一个重大挑战。 面对耐药,联合用药有时有助于克服耐药性,但药物组合的数量远远超过了可以进行临床试验的数量,此外还需要综合考虑患者承受的经济负担以及毒副作用等等。 因此,我们需要基于对耐药性相关潜在分子机制的深入了解,来确定潜在有效的药物组合来对抗耐药性。 通过上文关于靶向治疗药物的核心原理我们知道「对激活的原癌基因抑制可以产生治疗响应」。这个逻辑在大多数时候都没有问题,但在一些情况下会有意外发生。 维莫非尼 vemurafenib 是第一种被批准用于BRAF突变癌症的药物,其在BRAF突变的黑色素瘤中显示出了很不错的临床效果。但是在结直肠癌的一项临床实验中,21名接受治疗的患者中只有1名患者确认为部分缓解(PR),中位无进展生存期为2.1个月。 第二个意想不到的临床发现是,阻断KRAS蛋白下游的MEK激酶,对KRAS突变癌症的治疗无效。2017年发表在JAMA的一项研究显示,含有KRAS突变的NSCLC患者,MEK抑制剂Selumetinib 联合多西他赛相比于多西他赛加安慰剂,在PFS和OS上,都没有显示出更优的效果。 对于这类患者在一开始就对治疗没有反应的情况,将其称之为原发性耐药(intrinsic resistance)。 不同癌种不同药物的临床研究发现,这类原发性耐药的另外一类情况是,有时A基因的突变会导致针对B基因突变的药物无效。 比如EGFR单克隆抗体西妥昔单抗可以用于治疗晚期结直肠癌。西妥昔单抗2004年就首次被批准用于临床治疗。但是这类EGFR抗体并非对于所有CRC患者都有效。 KRAS是EGFR下游信号的一个重要组成部分,约30-40%的CRC会发生该基因的激活突变。当西妥昔单抗阻断EGFR信号时,突变的KRAS蛋白还可以维持EGFR下游的信号传递,所以人们预计KRAS突变的结直肠癌对西妥昔单抗不起作用。 基于下游信号的突变激活与作用于同一信号级联上游的药物呈现原发耐药这一个观点,人们发现KRAS野生型,但是BRAF和NRAS突变型CRC患者对EGFR抗体的反应也非常差。 类似的,曲妥珠单抗被批准用于治疗HER2阳性的乳腺癌患者中,但是当这些患者存在PIK3CA突变时,其对曲妥珠单抗的反应就会更差。 基于以上几个事例,为了理解内在耐药性的机制,重要的是要认识到正常的细胞平衡在很大程度上取决于信号通路之间和内部的相互影响和反馈调节。比如为了维持平衡状态,对一条信号通路的抑制往往会导致第二条通路(或同一条通路)的补偿性增强。这种缓冲作用确保了生物系统的稳健性,但在癌症治疗中就变成了一个重大挑战。 除了以上介绍的原发性耐药,在靶向治疗中,另一种更加常见的耐药机制被称作获得性耐药(acquired resistance):指患者起初对于某种靶向药物具有明显反应,但是这种反应在治疗期间逐渐减少。 这样的例子很多,比如即便在KRAS野生型的CRC患者中使用西妥昔单抗,往往也会在治疗后几个月内发生获得性耐药。而获得性耐药机制的分析,最容易通过对同一患者耐药前后进行组织/液体活检进行比较研究,看看患者在这个过程中增加了哪些之前没有的基因突变。 获得性耐药的机制研究目前主要发现有两大类,分别是通过突变产生的遗传性耐药和由癌基因表达变化产生的非遗传性耐药。 通过突变产生的遗传性耐药,又可以宽泛地分为靶点依赖性 on-target 和非靶点依赖性 off-target 两类。 其中on-target可以理解为因为靶向激酶自身的突变,即便使用TKI也会出现持续的信号传导过程;off-target可以理解为靶向基因下游信号蛋白能够激活一个或多个旁路信号通路或者发生表型的转换。 🍺🍺试读结束🍺🍺 剩余内容是参加会员计划读者的专属内容 欢迎你通过会员计划支持我持续创作 如果你对这篇文章感兴趣,欢迎通过邮箱订阅我的 「熊言熊语」会员通讯,我将第一时间与你分享肿瘤生物医药领域最新行业研究进展和我的所思所学所想,点此链接即可进行免费订阅。
写在前面
靶向治疗核心原理

靶向药物的原发性耐药


靶向药物的获得性耐药
获得性耐药的遗传机制
· 分享链接 https://kaopubear.top/blog/2022-12-31-mechanisms-of-resistance/